总RNA提取试剂盒 选配的试剂 ![]() 储存条件
储存条件 ![]() 产品简介
产品简介 ![]() 预防RNase污染,应注意以下几方面
预防RNase污染,应注意以下几方面 ![]() 操作步骤
操作步骤 ![]() 附录Ⅰ:从酵母菌中提取总 RNA
附录Ⅰ:从酵母菌中提取总 RNA ![]() 附录Ⅱ:RNA Clean -Up 或基因组 DNA 去除。 品牌:genefist | 货号:TR01
附录Ⅱ:RNA Clean -Up 或基因组 DNA 去除。 品牌:genefist | 货号:TR01 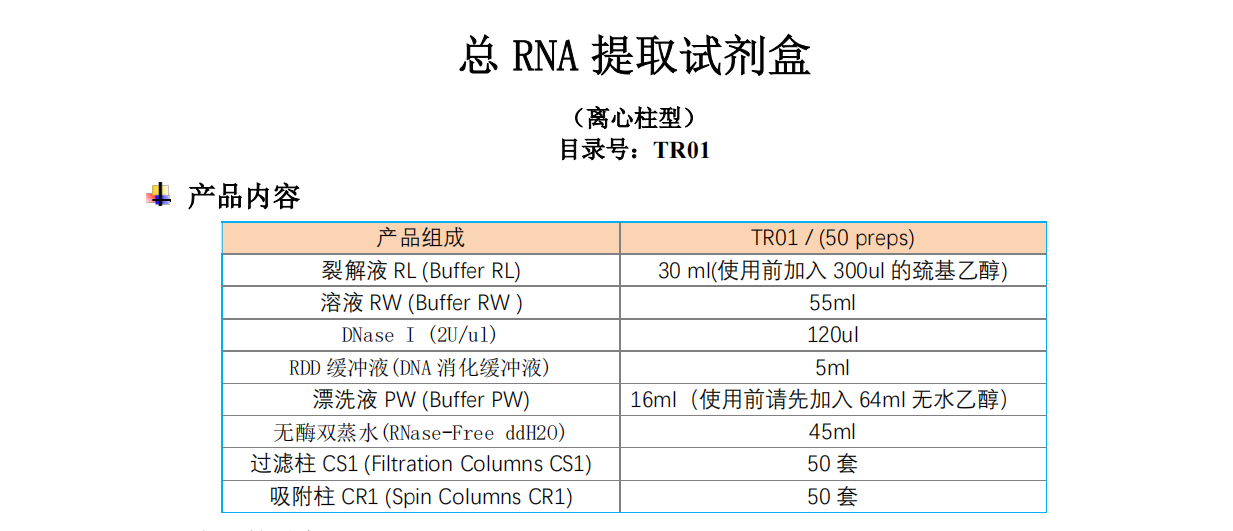
选配的试剂
蛋白酶K(20mg/ml)目录号:GF0202-01,客户自备,提取动物组织总RNA时需配备 溶菌酶(50mg/ml)目录号:GF0203-01,客户自备,提取细菌总RNA 时需配备
 储存条件
储存条件
DNase I溶液(DNase I 冻干粉溶解于专用保存液),储存于-20℃,可反复冻融; 其他试剂室温(15-25℃)保存。
 产品简介
产品简介
总RNA提取试剂盒提供了快速简单且有效的方法,可从各种动物组织、培养细胞及细菌、植物组织、 中提取总RNA。本试剂盒采用离心管柱的方式,配合使用我司独特的硫氰酸胍裂解液,使组织或细胞裂解 及均质化,并加入乙醇使RNA选择性的与管柱膜结合,于操作过程中加入DNase Ⅰ以去除残留的基因组DNA,经过多次“洗涤及离心”的步骤去除污染杂质,再以无核酸酶水回收结合在管柱膜上的RNA。若RNA 小于200nt,如5sRNA、tRNA和microRNA,无法在此系统中被有效地回收。提取的总RNA纯度高,基本没有DNA 和蛋白质污染,可用于PCR、芯片分析、Blot、PolyA 筛选、体外翻译、RNase 保护分析和分子克隆等多种下游实验。
本试剂盒同样适用酵母,可以从酵母菌中提取总RNA,具体操作方法见“附录Ⅰ”。
本试剂盒也可用于将以其他方法提取的 RAN 进行clean up 或去除基因组DNA 污染,详见“附录Ⅱ”。
 预防RNase污染,应注意以下几方面
预防RNase污染,应注意以下几方面
1. 经常更换新手套,因为皮肤经常带有细菌,可能导致RNase污染。
2. 使用无RNase的塑料制品和枪头避免交叉污染。
3. RNA在裂解液RL中时不会被RNase降解。但提取后继续处理过程中应使用不含RNase的塑料和玻璃器皿。玻璃器皿可在150℃烘烤4 h,塑料器皿可在0.5 M NaOH中浸泡10 min,然后用水彻底清洗,再灭菌,即可去除RNase。
4. 配制溶液应使用无RNase的水(将水加入到干净的玻璃瓶中,加入DEPC至终浓度0.1%(V/V),高压灭菌)。
![]() 使用前注意事项
使用前注意事项
1. 使用前请向裂解液RL 添加 350ul 巯基乙醇,添加过巯基乙醇的裂解液 4℃保存。
2. 使用前请向漂洗液PW 添加 64ml 无水乙醇。
3. 为确保RNA 的品质及产量,应尽量收取新鲜的动物组织进行 RNA 提取,或将组织立即以液氮冷冻,储存于-70℃,组织亦可保存在RANstore 样本保存液(目录号:TR38)中。样本保存在 RNAstore 试剂中,可于37℃存放 1 天、4℃存放 1 个月、-20℃永久保存,所提取的 RNA 品质与储存在液氮中相同。
 操作步骤
操作步骤
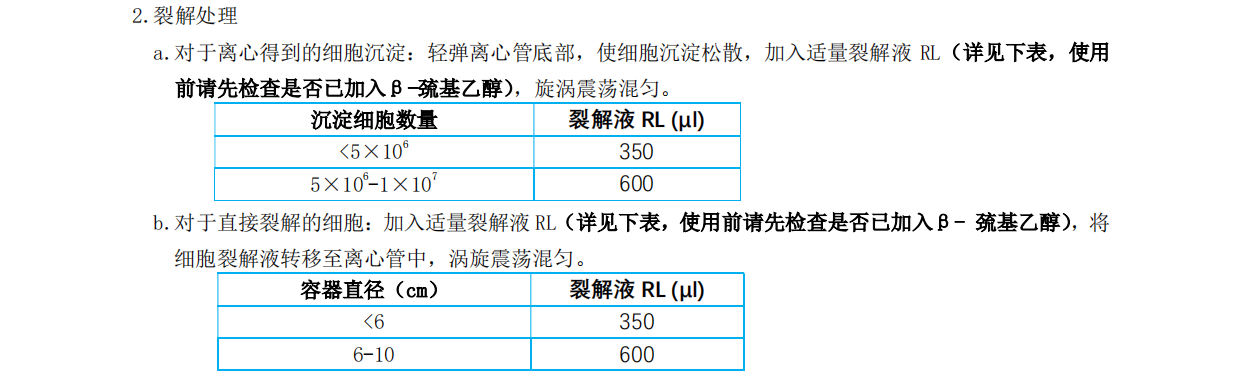
一、从培养细胞中提取总 RNA
1. 收集细胞
a. 悬浮细胞的收集(收集细胞数量请不要超过 1×107):估计细胞数量,300×g 离心 5 min,将细胞收集到离心管中,仔细吸除所有培养基上清。
b. 单层贴壁细胞的收集(收集细胞数量请不要超过 1×107):可直接在培养容器中裂解(容器直径不超过 10 cm),或者使用胰蛋白酶处理后离心收集细胞沉淀。(在摇瓶中培养的单层贴壁细胞通常采用胰蛋白酶处理的方法。)
Ø 直接裂解法:确定细胞数量,彻底吸除细胞培养基上清,立即进行第 2 步裂解步骤。
Ø 胰蛋白酶处理法:确定细胞数量,吸除培养基,用 PBS 洗涤细胞,吸除 PBS,向细胞中加入含有0.10-0.25%胰蛋白酶的 PBS 处理细胞,当细胞脱离容器壁时,加入含有血清的培养基失活胰蛋白酶,将细胞溶液转移至RNase-Free 的离心管中,300×g 离心 5 min,收集细胞沉淀,仔细吸除所有上清。
注意:收集细胞时一定要将细胞培养液去除干净,否则会导致裂解不完全,影响 RNA 与吸附柱的结合, 造成RNA 的产量降低;请勿使用过多的样本量,避免管柱杜塞而造成 RNA 的产量降低。
3. 将所有溶液转移至过滤柱 CS1 上(过滤柱 CS1 放在收集管中),12,000 rpm(~13,400×g)离心 2min,收集滤液。
4. 向滤液加入等体积 70%乙醇至裂解液中,混匀(此时可能会出现沉淀),转至后面“RNA 提取步骤”。
二、从动物组织中提取总 RNA
1. 匀浆处理:
每 10-20 mg 组织加 300 μl 裂解液RL(使用前请先检查是否已加入 β-巯基乙醇),用研磨杵将组织彻底研磨(如组织较难彻底研磨,可选用电动或玻璃匀浆器);随后向匀浆液 中加入 590 μl RNase-Free ddH2O 和
10 μl Proteinase K(20mg/ml),混匀后 56℃处理 10-20 min。
注意:组织量一定不要超过 20 mg,否则将导致RNA 得率和质量下降。
2. 将裂解混合液转移至过滤柱 CS1(过滤柱 CS1 放入收集管中),12,000 rpm(~13,400×g)离心 2min,收集滤液。
3. 向滤液加入 0.5 倍上清体积的无水乙醇,均匀(此时可能会出现沉淀),转至后面“RNA 提取步骤”。
三、从细菌中提取总RNA
1.4℃12,000 rpm(~13,400×g)离心 2 min 收集菌体(收集菌体的最大量不超过 1×109),仔细去除所有培养基上清,以后的所有离心步骤均在室温(20-25℃)进行。
注意:如果培养基上清去除不完全,将对第二步中的细胞壁消化过程产生抑制。
2. 用含有溶菌酶的 100μl TE 缓冲液(客户自己配制,配制方法见下表)彻底重悬菌体,孵育时间见下表。
|
|
TE 缓冲液中的溶菌酶终浓度 |
孵育时间(室温) |
|
G-细菌 |
400 μg/ ml |
3-5 min |
|
G+细菌 |
3 mg/ ml |
5-10 min |
3. 加入 350μl 裂解液 RL(使用前请先检查是否已加入β-巯基乙醇),涡旋振荡混匀。
4. 将裂解混合液转移至过滤柱 CS1 上(过滤柱CS1 放入收集管),12,000 rpm(~13,400×g)离心 2min,收集滤液。
5. 向滤液中加入 250μl 无水乙醇,混匀(此时可能会出现沉淀),转至后面“RNA 提取步骤”。
四、从植物组织中提取总 RNA
本试剂盒不适用于富含淀粉、酚类和次级代谢物的植物组织(例如一些木本植物,胚乳或丝状真菌的菌 丝体),因为 2-ME/裂解液在加入至样本粉末后,会变固态或非常粘稠,此类植物组织请使用“多糖多酚植物总RNA 提取kit”(货号 TR22)。
1. 匀浆处理
50-100 mg 植物叶片在液氮中迅速研磨成粉末,加入 450 μl RL(使用前请先检查是否已加入β-巯基乙醇),涡旋剧烈震荡混匀,并于 56℃孵育 3 分钟。
注意 1:在 56℃孵育 1-3 min 将有助于植物组织裂解,但是对于某些富含淀粉的样品,请不要加热处理, 防止因淀粉引起的样品膨胀现象。
注意 2:由于植物多样性非常丰富,而且同种植物的不同生长发育阶段和不同组织的 RNA 含量都不相同, 请根据具体实验情况选择合适的植物材料的用量。
2. 将所有溶液转移至过滤柱 CS1 上(过滤柱 CS1 放在收集管中),12,000 rpm(~13,400×g)离心 2-5 min,小心吸取收集管中的上清至RNase-Free 的离心管中,吸头尽量避免接触收集管中的细胞碎片沉淀。
注意:由于裂解液较粘稠,所以将溶液转移至过滤柱时,可以剪去部分吸头末端。
3. 缓慢加入 0.5 倍上清体积的无水乙醇,混匀(此时可能会出现沉淀),转至“RNA 提取步骤”。
u RNA 提取步骤
此为续接样本制备“一、二、三、四、五”后的RNA 提取操作步骤。
1. 将前一步所得“裂解液/乙醇混合液”(含沉淀),移取至吸附柱 CR1 中(吸附柱 CR1 放入收集管中),12,000 rpm (~13,400×g )离心 30-60 sec,倒掉收集管中的废液,将吸附柱 CR1 放回收集管中。
注意:将溶液和沉淀转移至吸附柱CR1 时,如果体积大于吸附柱容量,可以分次完成。
2. 向吸附柱CR1 中加入 500ul 溶液RW,12,000 rpm (~13,400×g )离心离心 1 min,丢弃滤液,将吸附柱CR1 放回收集管中。
3. DNase Ⅰ降解。
每一纯化反应,请将 80 ul DNase 消化液与 2ul DNaseⅠ预先混合在新的离心管(轻弹或翻转离心管以混合均匀,请勿震荡),将 82 ul “DNaseⅠ工作液”加入至吸附柱的膜中心,于室温(25~28℃)孵育15 分钟。
注意:如同时操作多组样本,请使用前现配新鲜的 DNaseⅠ工作液,请勿预先配制保存 DNaseⅠ工作液。4.向吸附柱CR1 中加入 500μl 溶液RW,12,000 rpm(~13,400×g)离心 1 min,倒掉收集管中的废液,将吸
附柱CR1 放回收集管中。
5. 向吸附柱CR1 中加入 600μl 漂洗液 PW(使用前请先检查是否已加入乙醇),12,000 rpm(~13,400×g) 离心 1 min,倒掉收集管中的废液,将吸附柱CR1 放回收集管中。
6. 重复操作步骤 5。
7.12,000 rpm(~13,400×g)离心 3 min,将吸附柱CR1 置于室温放置数分钟,以彻底晾干吸附材料中残余的乙醇。
注意:此步骤目的是将吸附柱中残余的漂洗液去除,离心后将吸附柱 CR1 在室温放置片刻,以充分晾干。如果有漂洗液残留,可能会影响后续的 RT 等实验。
8. 将吸附柱CR1 转入一个新的 RNase-Free 离心管中,加入 30-100 μl 无酶双蒸水至吸附柱的膜中心,室温静置 2 min,12,000 rpm(~13,400×g)离心 1 min,得到 RNA 溶液。
注意:洗脱缓冲液体积不应少于 30 μl,体积过小影响回收效率;RNA 溶液请于-70℃保存。
 附录Ⅰ:从酵母菌中提取总 RNA
附录Ⅰ:从酵母菌中提取总 RNA
一、需要自备的试剂:
a.溶壁酶(Lyticase):目录号 GF0210-01 b.山梨醇 buffer:
用0.1M磷酸钠缓冲液(pH7.4)配制1.2 M山梨醇;
0.1M磷酸钠缓冲液(pH7.4)的配制:77.4 ml 0.1 mol/L Na2HPO4+ 22.6ml 0.1mol/L NaH2PO4
二、操作步骤
1. 取酵母细胞(最多不超过5×107cells),12,000 rpm(~13,400×g )离心1 min,尽量吸除上清(菌液较多时可以通过几次离心将菌体沉淀收集到一个离心管中)。
2. 酵母细胞壁的破除:
酶法:向菌体中加入1ml山梨醇buffer,加入大约50U Lyticase(需自备,我司目录号:GF0210-01)充分混匀,30℃孵育30min,300×g离心5 min,弃上清,收集沉淀。
注意:以上为5×107酵母细胞的Lyticase用量,根据酵母的菌株和酵母细胞数量的不同,所用Lyticase 的浓度和孵育时间应该进行适当调整。
3. 加入 350 μl 裂解液 RL(在使用前请加入 β-巯基乙醇),涡旋振荡混匀,将裂解混合液转移至过滤柱 CS1
上(过滤柱 CS1 放入收集管中),12,000 rpm(~13,400×g)离心 2min,收集滤液。
4. 向滤液中加入 350μl 70%乙醇,混匀(此时可能会出现沉淀),转至上面“RNA 提取步骤”。
 附录Ⅱ:RNA Clean -Up 或基因组 DNA 去除。
附录Ⅱ:RNA Clean -Up 或基因组 DNA 去除。
本试剂盒可用于将以其他方法提取的 RAN 进行clean up 或去除基因组DNA 污染。
1. 将RNA 以无酶水调整体积至 100ul,加入 350ul 的裂解液 RL(使用前请加入β 巯基乙醇),混合均匀。
2. 加入 250ul 的无水乙醇至裂解液中,混匀,转至上面“RNA 提取步骤”。
上海金畔生物科技有限公司代理各种进口试剂耗材,欢迎来电咨询18301939375,量多优惠。网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。
