脂多糖提取试剂盒 Lipopolysaccharide(LPS)Extraction Kit
货号:17141
规格:100次
品牌:intronbio
试剂盒组成
|
组分
|
名称
|
规格
|
保存方法
|
|
1
|
Lysis Buffer
|
1x 100 ml
|
2~8℃
|
|
2
|
Purification Buffer
|
1x 80ml
|
2~8℃
|
LPS背景描述:
◆ 脂多糖(LPS)是革兰氏阴性菌细胞壁外膜的主要成分,结构很复杂、热稳定性*(在250℃下干热灭菌2h才*灭活)。受LPS发现的历史原因,如今LPS的概念几乎等同于内毒素(endotoxin)。LPS由多糖链和脂质A组成,不同细菌间的多糖链是高度变化的,决定细菌的血清型;而脂质A主要影响LPS的毒性作用。LPS可以引起免疫刺激的级联反应和机体的毒性病理生理活动,包括释放内毒素引起感染性休克从而导致末梢血管虚脱。临床常通过检测LPS的存在来诊断脑膜炎。
◆ 正是LPS与机体免疫机能的密切关系,生命科学研究常常提取LPS进行相关的研究,如阐明LPS的结构,代谢,免疫学,生理学,毒性,生物合成途径;诱导生长促进因子如白介素的合成与分泌;诱导疾病研究的动物模型如炎症反应,急性肺损伤,
产品描述:
◆ 常用的LPS提取方法仍然是Westphal,O. (1965)使用的热酚–水法(hot phenol-water method),主要优势在于高产量,但是提取步骤繁琐,费时,以及常受蛋白质和核酸的污染,纯度低等缺点也常困扰科研工作者。
◆ iNtRON提供的LPS提取试剂盒是市场上的个商品化的产品,排除传统热酚–水法的缺陷,使得科研工作者能够快速方便的从细菌中提取LPS。
产品优势:
∷ 适用性广,能从所有G–菌中提取LPS(见Fig. 2);
∷ 操作时间短(包括裂解在内,60min内即可完成);操作简单方便;
∷ 少量细菌即可获得足够的LPS;LPS产量与细菌培养物成正比,一般使用3~5ml培养物LPS产量高;细菌适合培养体积1~2ml(OD600=0.8-1.2)
∷ LPS产率高,且重复性好(见Fig.1);
∷ 提取LPS下游应用广,包括直接用于免疫刺激;
操作步骤:
1)室温离心收获细菌细胞,13,000rpm,30sec。
2)加入1ml裂解缓冲液(Lysis Buffer),剧烈涡旋混匀。
3)加入200μl氯方,剧烈涡旋混匀10-20 sec,室温孵育5min。
4)4℃,13,000rpm离心10min,转移400μl上清到新1.5ml离心管中。
5)加入800μl纯化裂解液(Purification Buffer),并混匀。-20℃孵育10min。
6)4℃,13,000rpm离心15min。
7)用1ml 70%EtOH洗涤LPS颗粒,并*干燥。
8)在LPS中加入70μl Tris-HCL(10mM,pH8.0),并超声。
技术数据
LPS提取率
|
应变
|
LPS收率(μg) |
蛋白质污染* |
| 鼠伤寒沙门氏菌 |
200 ~ 400 |
< 0.2微克 |
| 肠炎链球菌 |
90 ~ 250 |
< 0.2微克 |
| S. gallinarum (沙氏菌) |
150 ~ 450 |
< 0.2微克 |
| 大肠杆菌(野生型) |
220 ~ 490 |
< 0.2微克 |
| 大肠杆菌 (O:055) |
260 ~ 510 |
< 0.2微克 |
| 大肠杆菌 (O:111) |
220 ~ 500 |
< 0.2微克 |
| 大肠杆菌 (O:1) |
180 ~ 380 |
< 0.2微克 |
| 大肠杆菌 (O:2) |
180 ~ 380 |
< 0.2微克
|
5 使用LPS提取试剂盒从OD600的每个G(-)菌株中提取LPS后,使用Purpald测定法对提取的LPS进行定量,结果证实了上述提取效率。另一方面,使用我们的 SMART™ Micro BCA 检测试剂盒观察到蛋白质的存在,并确认污染小于 0.2 μg。
从不同菌株中提取的LPS的条带模式
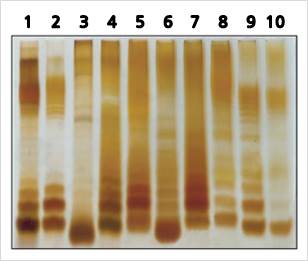
泳道 1 : 鼠伤寒沙门氏菌 泳道 2 : 肠炎
链球菌 泳道 3 : 大肠杆菌 (O055) 泳道 4 : 大肠杆菌 (O111) 泳道 5 : 鼠伤寒沙门氏菌 泳道 6 : 肠炎
链球菌 泳道 7 : 鼠伤寒沙门氏菌 泳道 8 : 大肠杆菌 (野生tyoe) 泳道 9 : 大肠杆菌 (O111) 泳道 10 : 大肠杆菌 (O2)
由于从各种类型的革兰氏阴性细菌中提取的LPS的SDS-PAGE后银染色,根据作为多聚体存在的LPS的特征和多聚体的数量,观察到阶梯形式的条带模式。据观察,模式存在差异。
产品检测数据图片:

引文列表:
| 1 |
Vaccine
Volume 36, Issue 29, 5 July 2018, Pages 4153-4156 |
Immunization with lipopolysaccharide-free outer membrane complexes protects against Acinetobacter baumannii infection |
Marina R. Pulido a, Meritxell García-Quintanilla a, Jerónimo Pachón a, b, Michael J. McConnell |
Spain |
| 2 |
bioRxiv, 2023 |
Understanding the Mechanisms of Salmonella Typhimurium resistance to Cannabidiol |
Iddrisu Ibrahim, View ORCID ProfileJoseph Atia Ayariga, Junhuan Xu, Daniel A. Abugri, Robertson K. Boakai, Olufemi S. Ajayi |
USA |
| 3 |
Biosensors 2022, 12, 153. https://doi.org/10.3390/bios12030153 https://www.mdpi.com/journal/biosensors |
A Novel Peptide as a Specific and Selective Probe for Klebsiella pneumoniae Detection |
Hyun Kim, Ju Hye Jang , Young Jung, Ju Hyun Cho |
Korea |
| 4 |
Int. J. Mol. Sci. 2022, 23, 5442. https://doi.org/10.3390/ijms23105442 https://www.mdpi.com/journal/ijms |
Prunetinoside Inhibits Lipopolysaccharide-Provoked Inflammatory Response via Suppressing NF-κB and Activating the JNK-Mediated Signaling Pathway in RAW264.7 Macrophage Cells |
Abuyaseer Abusaliya, Pritam Bhagwan Bhosale, Hun Hwan Kim, Sang Eun Ha, Min Yeong Park, Se Hyo Jeong , Preethi Vetrivel, Joon-Suk Park, Gon Sup Kim |
Korea |
| 5 |
Journal of Oral Biosciences
Available online 2 June 2022 |
Green tea catechins inhibit Porphyromonas gulae LPS-induced inflammatory responses in human gingival epithelial cells |
ShoYoshida, HiroakiInaba, RyotaNomura, Kazuhiko Nakano, Michiyo Matsumoto-Nakano |
Japan |


